پیری قرار نیست فقط در چینهای پوست یا عدد روی شناسنامه دیده شود بلکه در عمق بدن ما اتفاق میافتد. سلولهایی که روزی بدون خطا تقسیم میشدند، با دقت انرژی تولید میکردند و آسیبها را ترمیم میکردند، به مرور توانایی خود را از دست میدهند. نتیجه کاهش تدریجی عملکرد بدن و افزایش احتمال بیماریهایی مانند دیابت، آلزایمر و مشکلات قلبی است. اما پرسش مهم اینجاست: چه سازوکاری باعث میشود بدن از نقطهٔ تندرستی به سمت فرسایش حرکت کند؟
برای پاسخ به این سؤال، دانشمندان بهدنبال الگوی مشترک این فرسایش رفتهاند. در سال ۲۰۱۳، تیمی از پژوهشگران به سرپرستی کارلوس لوپز-اُتین در مقالهای در مجلۀ Cell نشان دادند که پیری تنها یک اتفاق تصادفی نیست؛ بلکه مجموعهای از دگرگونیهای سلولی و مولکولی قابلبررسی دارد. آنها این دگرگونیها را تحت عنوان نشانههای پیری (Hallmarks of Aging) دستهبندی کردند.
پیشرفت علم طی یک دههٔ اخیر، تصویری کاملتر به ما داده است. در سال ۲۰۲۲، سه نشانهٔ جدید به این فهرست افزوده شد و اکنون ۱۲ هالمارک پیری، ۱۲ نقطهٔ کلیدی وجود دارد که اگر آنها را درک و مدیریت کنیم، میتوانیم روند پیری را آهستهتر، هدفمندتر و سالمتر طی کنیم.
نشانگان پیری چیستند و از کجا آمدهاند؟
برای درک پیری، کُندکردن یا مهار آن به زبانی مشترک و طبقهبندی تغییرات پیچیدۀ بدن نیاز داریم. مفهوم هالمارکها یا نشانگان پیری (Hallmarks of Aging) از همینجا شکل گرفت. این واژه تنها به نشانههای ظاهری پیری اشاره ندارد؛ بلکه به ریشههای مولکولی و سلولی، جایی که خود روند پیر شدن آغاز میشود، میپردازد. هر «نشانهٔ پیری» سه ویژگی اساسی دارد:
- با افزایش سن در بدن ظاهر میشود،
- تشدید آن میتواند پیری را سرعت دهد،
- و با اصلاح یا مهار آن، روند پیری میتواند آهسته یا حتی تا حدی معکوس شود.
این نشانههای پیری پایههای زیستی روند پیر شدن هستند و هر کدام بخشی از سیستمهای حیاتی مانند ترمیم DNA، تولید انرژی، ایمنی یا تعادل متابولیک را تحتتأثیر قرار میدهند. قرار گرفتن آنها کنار یکدیگر، تصویری منسجم از اینکه چرا و چگونه پیر میشویم، ارائه میکنند.
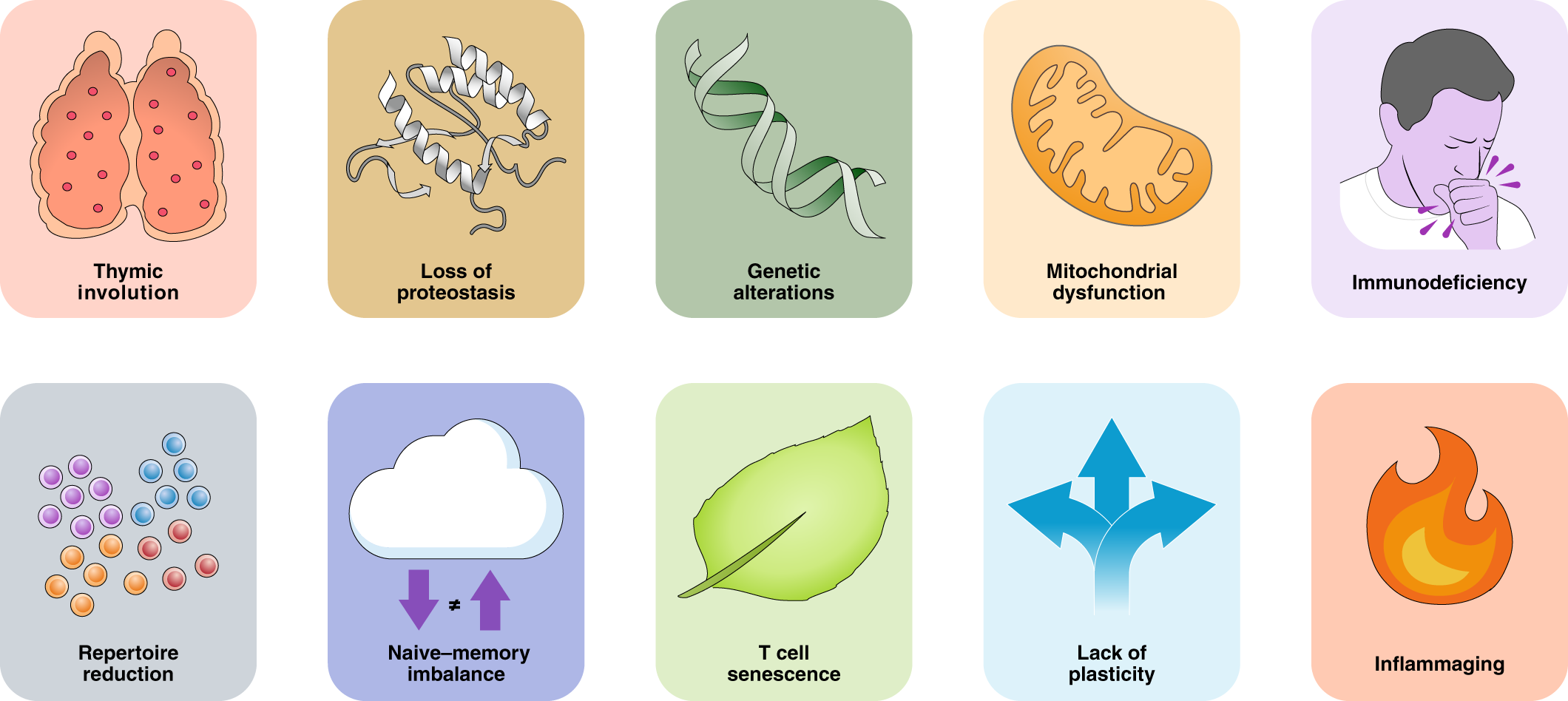
آشنایی با ۱۲ نشانۀ اصلی پیری
دانشمندان مجموعهای از دگرگونیهای سلولی و مولکولی را که بهمرور زمان توان بدن را کاهش میدهند، در قالب ۱۲ نشانهٔ پیری دستهبندی میکنند. هر نشانه در بخشی از زیستشناسی بدن رخ میدهد، اما این تغییرات جدا از هم عمل نمیکنند و بهصورت شبکهای پیوسته، مسیر سلامت و طول عمر ما را رقم میزنند.
در ادامه، با این ۱۲ نشانۀ اصلی پیری از دید علم آشنا میشویم:
- ناپایداری ژنومی (Genomic instability)
- کوتاهشدن تلومرها (Telomere attrition)
- تغییرات اپیژنتیک (Epigenetic alterations)
- اختلال در پایداری پروتئینها (Loss of proteostasis)
- اختلال در حسکرد مواد مغذی و انرژی (Deregulated nutrient sensing)
- اختلال عملکرد میتوکندری (Mitochondrial dysfunction)
- پیری سلولی (Cellular senescence)
- فرسودگی سلولهای بنیادی (Stem cell exhaustion)
- اختلال در ارتباط بینسلولی (Altered intercellular communication)
- اختلال در خودخواری سلولی (Disabled macroautophagy)
- التهاب مزمنِ مرتبط با سن (Chronic inflammation / Inflammaging)
- برهمخوردن تعادل میکروبیوم بدن (Dysbiosis)
ناپایداری ژنومی (Genomic instability)
از جمله ویژگیهای مشترک همهٔ موجودات زنده در روند پیری، تجمع تدریجی آسیبهای ژنتیکی در طول عمر است. مولکول DNA، که نقشهٔ اصلی ساخت و عملکرد بدن را در خود دارد، هر لحظه در معرض خطر است: تابشهای محیطی، مواد شیمیایی، آلودگی، خطاهای طبیعی هنگام همانندسازی ژنها و حتی محصولات جانبی متابولیسم (مثل رادیکالهای آزاد) میتوانند به آن آسیب بزنند. سلولها برای مقابله با این آسیبها، شبکهای از سیستمهای ترمیم دارند که مدام DNA را پایش و بازسازی میکند اما با افزایش سن، این سیستمهای حفاظتی ضعیفتر میشوند و خطاهای کوچک یکییکی انباشته میشوند. در نتیجه، ثبات ژنتیکی از بین میرود و سلول دیگر نمیتواند اطلاعات حیاتی خود را بازتولید کند. دانشمندان این پدیده را ناپایداری ژنومی مینامند، وضعیتی که زمینهساز جهشها، اختلال در عملکرد سلول و در نهایت پیری بافتی است.
نمونههای بارز اختلال در این مسیر را میتوان در بیماریهای پیری زودرس مثل سندروم ورنر (Werner syndrome) و سندروم بلوم (Bloom syndrome) دید که نقص در ترمیم DNA باعث میشود بدن خیلی زودتر از حالت طبیعی دچار علائم پیری شود.
کوتاهشدن تلومرها (Telomere attrition)
در انتهای هر کروموزوم، بخشهایی محافظ به نام تلومر قرار دارند که از آسیب دیدن «رشتههای DNA» جلوگیری میکنند. اما هر بار که سلول تقسیم میشود، بخشی از این تلومر از بین میرود. با گذشت زمان و تقسیمهای مکرر، تلومرها کوتاهتر و شکنندهتر میشوند تا جایی که دیگر نمیتوانند از DNA محافظت کنند. در این مرحله، سلول به دو انتخاب میرسد: یا وارد وضعیت «پیری سلولی» میشود (یعنی دیگر تقسیم نمیکند) یا میمیرد. این اتفاق یکی از مکانیسمهای طبیعی بدن برای جلوگیری از بروز سرطان است، اما در عین حال، باعث کاهش توان بازسازی بافتها و تسریع پیری میشود. دانشمندان در مقالهٔ Cell 2013 نشان دادند که کوتاهشدن تلومرها یکی از پایهایترین دلایل پیری در سطح سلولی است.
تغییرات اپی ژنتیک (Epigenetic alterations)
در بدن ما بیش از بیست هزار ژن وجود دارد اما آنچه فعال یا خاموشبودن آنها را تعیین میکند، فراتر از خود DNA است و به آن اپی ژنتیک (به معنی فراتر از ژن) میگویند. اپیژنتیک مجموعهای از تنظیمات ظریف در اطراف DNA است که مانند دکمههای روشن و خاموش روی ژنها عمل میکند. این تنظیمات تعیین میکنند هر سلول چه کاری انجام دهد، چه پروتئینهایی بسازد و در چه زمانی فعال شود. اما با گذر زمان، این الگوهای تنظیمی دچار آشفتگی میشوند.
بر اساس یافتههای مقالهٔ Cell در سال ۲۰۱۳، پیری با سه نوع تغییر اپیژنتیکی مهم همراه است:
- کاهش متیلاسیون DNA؛ تغییری که میتواند ژنهای غیرفعال را دوباره روشن کند و نظم ژنتیکی را بر هم بزند.
- دگرگونی در هیستونها؛ پروتئینهایی که DNA را بستهبندی و تنظیم میکنند، وقتی شکل یا تعدادشان تغییر کند، نحوهٔ دسترسی سلول به ژنها نیز مختل میشود.
- برهم خوردن ساختار سهبعدی کروماتین؛ یعنی آرایشی که مکان ژنها را در هسته تعیین میکند و برای هماهنگی عملکرد ژنها حیاتی است.
نکتهٔ جالب اینجاست که برخلاف توالی ژنها، تغییرات اپیژنتیکی قابل برگشتاند و عواملی میتوانند الگوهای اپیژنتیکی را تا حدی به حالت متعادل برگردانند.
اختلال در پایداری پروتئینها (Loss of proteostasis)
پروتئینها از مهمترین مولکولهای بدن هستند و هر سلول روزانه هزاران پروتئین میسازد تا کارهای مختلفی مانند ترمیم بافتها، تنظیم متابولیسم و ارسال پیامهای سلولی، انجام دهد. اما برای اینکه هر کدام از این پروتئینها درست کار کنند، باید شکل دقیقی بگیرند؛ درست مثل قطعاتی که فقط در حالتی خاص در پازل جا میگیرند. در سلولهای جوان، سیستمهای دقیقی وجود دارد که تولید و عملکرد پروتئینها را کنترل میکنند. این سیستمها مطمئن میشوند که هر پروتئین درست ساخته، اگر آسیب دید، ترمیم شود و در زمان مناسب از بین برود. به این نظم طبیعی بین ساخت، نگهداری و حذف پروتئینها، اصطلاحاً پایداری پروتئینها (Proteostasis) میگویند. اما با افزایش سن، این نظم بهتدریج بههم میریزد. سلول دیگر نمیتواند همهٔ پروتئینهای آسیبدیده را ترمیم یا پاکسازی کند و در نتیجه پروتئینهای خراب یا تغییرشکلداده درون سلول جمع میشوند.
دانشمندان نشان دادند که از بین رفتن این تعادل، یکی از پایههای اصلی پیری سلولی است. در نسخهٔ جدیدتر Cell 2022 نیز توضیح داده شده که همین فرایند در بسیاری از بیماریهای وابسته به سن، از جمله آلزایمر، پارکینسون و ALS، که پروتئینهای معیوب در سلولهای عصبی انباشته میشوند و آنها را از کار میاندازند، دیده میشود.
خوشبختانه، بدن ما برای مقابله با این اتفاق ابزارهایی دارد مثلاً پروتئازوم و اتوفاژی (سیستم پاکسازی سلولی) که مانند تیم بازیافت در سلول عمل میکنند. هر چند عواملی مثل استرس مزمن، خواب ناکافی، رژیم غذایی ناسالم و افزایش سن میتوانند این سیستمهای دفاعی را تضعیف کنند.
اختلال در حسکرد مواد مغذی و انرژی (Deregulated nutrient sensing)
عملکرد سالم بدن به این وابسته است که سلولها بتوانند وضعیت تغذیه و انرژی خود را بهدرستی تشخیص دهند؛ اینکه آیا زمان رشد و تقسیم فرا رسیده یا زمان ذخیره، ترمیم و استراحت است، بر عهدهٔ شبکهای از حسگرهای درونسلولی قرار دارد که دائم سطح قند، چربی، اسیدهای آمینه و انرژی در دسترس را پایش میکنند. در سالهای جوانی، این سیستم بسیار منظم و دقیق عمل میکند. اما با افزایش سن، این تنظیمگری مختل میشود؛ سلولها پیغامهای نادرستی دریافت میکنند و اغلب بیش از حد در وضعیت «مصرف و رشد» باقی میمانند. در این حالت، انرژی بیشتری مصرف، آسیبها سریعتر انباشته میشود و فرصت کافی برای ترمیم و بازیابی از بین میرود.
پژوهشها نشان میدهند که این اختلال یکی از دلایل مهم افزایش بیماریهایی مثل چاقی، دیابت نوع ۲ و مشکلات متابولیک در سنین بالاست.
اختلال عملکرد میتوکندری (Mitochondrial dysfunction)
میتوکندریها را معمولاً نیروگاه سلول مینامند؛ جایی که غذای مصرفی ما به انرژی قابلاستفاده برای بدن تبدیل میشود. علاوه بر تولید انرژی، میتوکندریها نقش مهمی در تنظیم مرگ سلولی، ایمنی و مدیریت مولکولهای آسیبرسان در بدن دارند. با افزایش سن، میتوکندریها بهتدریج کارایی خود را از دست میدهند. آنها انرژی کمتری تولید میکنند و در عوض، مقدار بیشتری مولکولهای ناپایدار به نام «رادیکالهای آزاد» یا ROS آزاد میشود. این مولکولها اگر بیش از حد جمع شوند، به سلولها آسیب میزنند، التهاب را افزایش میدهند و سرعت پیری را بیشتر میکنند.
نتیجۀ این فرایند در بدن، کاهش توان بدنی، خستگی زودرس، کندتر شدن ترمیم بافتها، ضعف سیستم ایمنی و افزایش احتمال بیماریهای مرتبط با سن است.
خبر خوب این که میتوکندریها فقط مصرفکننده نیستند؛ آنها قابلیت تقویت و بازسازی دارند. مطالعات نشان دادهاند که ورزش منظم (بهخصوص تمرینات هوازی و استقامتی)، خواب کافی، تنفس درست، و برخی الگوهای تغذیهای که به بدن فرصت ترمیم میدهند، میتوانند تولید میتوکندریهای سالم را افزایش دهند و عملکرد آنها را بهبود بخشند.
پیری سلولی (Cellular senescence)
سلولهای بدن تنها تا زمانی مشخص میتوانند تقسیم و بازسازی شوند. وقتی یک سلول بهدلیل آسیب به DNA، کوتاه شدن تلومرها یا استرسهای شدید دیگر توان تقسیم خود را از دست میدهد، وارد حالتی به نام پیری سلولی میشود. در این حالت، سلول زنده میماند اما دیگر تکثیر نمیشود. این واکنش در اصل یک سازوکار دفاعی است تا جلوی تکثیر سلولهای آسیبدیده یا بالقوه سرطانی گرفته شود. اما اگر تعداد این سلولها زیاد شود و در بافت باقی بمانند، به یکی از عوامل تشدیدکنندهٔ پیری تبدیل میشوند. سلولهای پیر موادی آزاد میکنند که میتوانند التهاب ایجاد کنند و بر سلولهای سالم اطراف اثر منفی بگذارند. این التهاب پایدار باعث کاهش سرعت ترمیم بافتها، اختلال در عملکرد اندامها و افزایش احتمال بروز بیماریهای مرتبط با سن میشود.
در جوانی، بدن میتواند سلولهای پیر را پاکسازی کند، اما با افزایش سن این توانایی کمتر میشود و سلولهای پیر تجمع پیدا میکنند. همین تجمع تدریجی، یکی از دلایل اصلی کاهش تواناییهای جسمی و افزایش آسیبپذیری بدن در سنین بالاتر است.
فرسودگی سلولهای بنیادی (Stem cell exhaustion)
در بدن سالم، سلولهای بنیادی زمانی فعال میشوند که بافت آسیب دیده باشد و پس از ترمیم دوباره به حالت استراحت برمیگردند تا انرژی و توان خود را حفظ کنند. اما با افزایش سن، این چرخهٔ طبیعی مختل میشود. برخی سلولهای بنیادی آنقدر زیاد و بیوقفه فعال میمانند که توان تقسیمشان کاهش مییابد و زودتر فرسوده میشوند؛ گروهی دیگر بیشازحد در حالت استراحت باقی میمانند و دیرتر وارد عمل میشوند. در هر دو حالت، توان ترمیم بافتها کم میشود و بدن در برابر آسیبها و بیماریها آسیبپذیرتر خواهد بود.
فرسودگی سلولهای بنیادی به این معناست که منبع ترمیم بدن دیگر مثل جوانی کار نمیکند. وقتی این اتفاق میافتد، بدن نمیتواند سلولهای جدیدی تولید کند که جایگزین سلولهای فرسوده یا آسیبدیده شوند؛ بنابراین بافتها تحلیل میروند، ترمیم کُند میشود و خطر بیماریهای مرتبط با سن مثل ضعف عضلانی، پوکی استخوان، و اختلالات سیستم ایمنی افزایش پیدا میکند.
اختلال در ارتباط بینسلولی (Altered intercellular communication)
سلولهای بدن همیشه در حال تبادل پیام با یکدیگرند؛ پیامهایی که مشخص میکنند چه زمانی سلول رشد کند، خودش را ترمیم کند یا فعالیتش را کاهش دهد. این ارتباطها برای هماهنگی کل بدن ضروری هستند. اما با افزایش سن، این سیستم پیامرسانی دچار اختلال میشود.
در روند پیری، بخشی از سلولها دچار آسیبهای برگشتناپذیر و وارد وضعیتی به نام پیری سلولی میشوند. این سلولها برخلاف وظیفهٔ طبیعیشان، مواد التهابی آزاد میکنند و نوعی التهاب خفیف اما دائمی در بدن ایجاد میشود؛ پدیدهای که از آن با عنوان التهاب مرتبط با پیری (Inflammaging) یاد میشود. این التهاب مداوم انرژی بدن را مصرف میکند، عملکرد سلولهای سالم را نیز مختل کرده و هماهنگی میان سیستمهای هورمونی، عصبی و ایمنی را نیز کاهش میدهد. نتیجه این است که بدن بهجای حفظ سلامت، بیشتر درگیر مدیریت آسیبها میشود. نتیجهٔ این اختلال ارتباطی، کاهش توانایی بدن در ترمیم، افزایش حساسیت به بیماریها و کُند شدن عملکرد اندامهاست. به همین دلیل، اختلال در ارتباط بینسلولی یکی از نشانههای مهم پیری بهشمار میرود: پیری فقط فرسوده شدن تکتک سلولها نیست؛ از هم گسیختگی هماهنگی کل بدن است.
اختلال در خودخواری سلولی (Disabled macroautophagy)
درون هر سلول، سیستمی هوشمند وجود دارد که مواد آسیبدیده، پروتئینهای معیوب و بخشهای فرسوده سلول را جمعآوری کرده و دوباره آنها را بازیافت میکند. این فرایند خودخواری سلولی یا اتوفاژی نام دارد و یکی از مهمترین راههای حفظ سلامت سلولهاست. با بالا رفتن سن، کارایی این سیستم کاهش پیدا میکند. سلولها دیگر نمیتوانند بهخوبی پسماندها و اجزای آسیبدیده را پاکسازی کنند. این مواد انباشته میشوند و محیط داخل سلول را مختل میکنند. نتیجه، کاهش تولید انرژی، اختلال در عملکرد پروتئینها و افزایش استرس سلولی است و احتمال بیماریهای مرتبط با سن هم افزایش پیدا میکند.
پژوهشهای معتبر نشان دادهاند که فعالبودن اتوفاژی برای سالم نگهداشتن بافتها بهویژه در مغز، ماهیچه و سیستم ایمنی، ضروری است. کاهش اتوفاژی در طول عمر با مشکلاتی مثل اختلالات عصبی، ضعف عضلانی و کاهش قدرت دفاعی بدن همراه است.
به زبان ساده:
وقتی اتوفاژی خوب عمل کند، سلولها مرتب تعمیر میشوند؛
وقتی از کار بیفتد، آسیبها جمع میشوند و روند پیری سرعت میگیرد.
التهاب مزمن مرتبط با سن (Chronic inflammation / Inflammaging)
التهاب واکنش طبیعی بدن برای محافظت و ترمیم است: وقتی جایی آسیب میبیند یا میکروبی وارد میشود، بدن پیام میدهد: تعمیرات شروع شود. سلولهای ایمنی به محل میرسند، مواد لازم برای پاکسازی و ترمیم را آزاد میکنند و بعد از برطرف شدن مشکل، این پاسخ فروکش میکند. این حالت کوتاهمدت و هدفمند، «التهاب حاد» است و مفید محسوب میشود.
با افزایش سن، بدن وارد وضعیتی از التهاب خفیف اما مداوم میشود؛ پدیدهای که به آن التهاب مرتبط با پیری (Inflammaging) میگویند. این التهاب الزاماً بهدلیل عفونت یا آسیب حاد نیست؛ بلکه از عواملی مانند تجمع سلولهای پیر و ترشح مواد التهابی آنها (SASP)، مختل شدن سیگنالدهی بین سلولها و کاهش دقت سیستم ایمنی ناشی میشود. چنین حالتی باعث میشود فرآیندهای دفاعی و ترمیمی که باید فقط در زمان نیاز فعال باشند، بهطور بیوقفه روشن بمانند. در نتیجه، سرعت ترمیم بافتها کاهش مییابد، عملکرد اندامها افت میکند و خطر ابتلا به بیماریهای مرتبط با سن مانند بیماریهای قلبیـ عروقی، دیابت نوع ۲، آرتروز، افزایش پیدا میکند.
برهمخوردن تعادل میکروبیوم بدن (Dysbiosis)
در رودهٔ ما میلیاردها میکروب مفید زندگی میکنند که به آنها میکروبیوم گفته میشود. این میکروبها به هضم غذا، تولید ویتامینها، تقویت سیستم ایمنی و حتی تنظیم خلقوخو کمک میکنند. یعنی بخشی از سلامت ما بهطور مستقیم به تعادل این جامعهٔ میکروبی بستگی دارد. با افزایش سن، این تعادل بهتدریج تغییر میکند: تعداد باکتریهای مفید کم میشود و در عوض میکروبهای فرصتطلب و التهابزا بیشتر میشوند. این تغییرات میتوانند التهاب خفیف و دائمی در بدن ایجاد کنند، هضم و جذب مواد مغذی را مختل کنند و سیگنالهای بین روده و مغز را تحتتأثیر قرار دهند. به همین دلیل، برهمخوردن میکروبیوم با مشکلاتی مثل ضعف سیستم ایمنی، افزایش چربی بدن، بیماریهای قلبی متابولیک و حتی اختلالات شناختی مرتبط دانسته میشود.
خبر خوب این است که میکروبیوم یکی از بخشهای قابلتغییر در روند پیری است. هر چه بهتر از میکروبهای مفید روده حمایت کنیم، بدن هم بهتر از ما در برابر پیری حمایت میکند.
چرا شناخت نشانههای پیری اهمیت دارد؟
بیشتر افراد به افزایش طول عمر فکر میکنند، اما کیفیت سالهایی که زندگی میکنیم، واقعیتی مهمتر است. آگاهی از اینکه روند پیری دقیقاً از کجا و چگونه شروع میشود، به ما امکان میدهد دورهٔ سالم، مستقل و فعال زندگیمان را طولانیتر کنیم.
نشانههای پیری نشان میدهند کدام سازوکارهای بدن با گذر زمان تحت فشار قرار میگیرند و بیشترین نقش را در بروز بیماریهای مرتبط با سن دارند. نکتهٔ کلیدی اینجاست که بسیاری از این فرآیندها قابلتغییر هستند: تغذیهٔ سالم، تحرک منظم، خواب باکیفیت و مدیریت استرس، میتوانند عملکرد سلولی را حفظ کرده یا حتی آن را بهبود دهند.
شناخت نشانههای پیری، توانایی پیشگیری قبل از درمان؛ مداخلۀ هدفمند و زودهنگام را افزایش میدهد که در نهایت به سلامت بیشتر، شادابی طولانیتر و پیری آهستهتر منجر میشود.
چگونه با شناخت نشانههای پیری، سالمتر زندگی کنیم؟
پیری حاصل تغییراتی است که کمکم در بدن اتفاق میافتد؛ اما سرعت این تغییرات برای همه یکسان نیست. امروز میدانیم که سن شناسنامهای تنها چیزی نیست که آیندهٔ سلامت ما را تعیین میکند. نکتۀ مهمتر این است که بدن ما در برابر ۱۲ تغییر اصلی مرتبط با پیری، در چه وضعیتی قرار دارد.
وقتی نشانههای پیری را بشناسیم، میفهمیم کدام بخش بدن زودتر تحت فشار قرار گرفته و یا باید به آن رسیدگی شود. یعنی روند پیری دیگر اتفاقی پنهان و ناگهانی نیست؛ میتوان آن را دید، سنجید و برایش برنامهریزی کرد. با انتخابهایی مثل تغذیه بهتر، خواب کافی، تحرک منظم و مدیریت استرس، میتوانیم بعضی از این تغییرات را کُندتر و سالهای بیشتری را سالم و پرانرژی زندگی کنیم.
در واقع بهجای منتظر ماندن برای بیماریها، میتوانیم از آنها جلوتر حرکت کنیم، اینجا دقیقاً نقش زینوم پررنگ میشود:
ما با بررسی مواردی مثل نتایج آزمایشهای خون، الگوی خواب، تحرک روزانه و سطح استرس، به شما نشان میدهیم کدام بخش بدن نیاز به توجه بیشتر دارد و برنامهای شخصیسازیشده برای حفظ سلامتیتان ارائه میکنیم.
پیری ادامه دارد؛ اما کیفیت آن، انتخاب ماست.
دیدگاهتان را بنویسید